

 更多“已知用0.1000mol·L-1NaOH溶液滴定0.1000…”相关的问题
更多“已知用0.1000mol·L-1NaOH溶液滴定0.1000…”相关的问题
A.8.74~10.70
B.6.74~9.70
C.6.74~10.70
D.5.74~9.70
利用二元弱酸H2A与NaOH反应配制pH为6.0的缓冲溶液,已知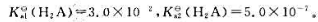 问在450mL0.10mol·L-1H2A溶液中需加入0.20mol·L-1NaOH溶液多少毫升?
问在450mL0.10mol·L-1H2A溶液中需加入0.20mol·L-1NaOH溶液多少毫升?
用盐酸滴定液(0.1000mol/L)滴定20mlNH4C1溶液(0.1000mol/L),化学计量点的pH值为
A.9.94
B.9.70
C.8.72
D.7.00
E.5.27
用氢氧化钠滴定液(0.1000mol/L)滴定20ml醋酸溶液(0.1000mol/L),化学计量点的pH为
A.8.72
B.7.00
C.5.27
D.4.3
E.3.5
用氢氧化钠滴定液(0.1000mol/L)滴定20ml醋酸溶液(0.1000mol/L),化学计量点的pH值为
A.8.72
B.7
C.5.27
D.4.3
E.3.5
0.1mol·L-1某一元弱酸(HA)溶液50mL与20mL 0.1mol·L-1NaOH溶液混合,将混合液稀释到100mL用酸度计测得溶液的pH=5.25.求HA的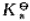 ?
?